Pour
comprendre pourquoi le verre est transparent nous
devons nous posez la question à l’envers et se
demander
pourquoi la plupart des
matériaux sont opaques. Chaque atome est
caractérisé par un spectre d'émission
et un spectre d'absorption que l’on appelle signature
spectrale qui ne change
jamais quelles que soit les conditions, cela fait parti de ses
propriétés.
Imaginons un
atome Z = 1
avec son noyau et son électron qui
aurait un spectre d’absorption avec une unique raie
rouge :
L’électron est sur une orbite
d’énergie donné, il est dans ce
qu’on appelle
« un état stationnaire
d'énergie. »
L'énergie de cet électron peut se calculer
grâce a la formule
suivante : l'équation de Bohr:
En
= - B (1/n2)
Où B est une
constante et est égal à 2,18 x 10-18
J
(joules).
Et n
est le nombre
quantique principal et qui correspond a
l’orbite sur laquelle
l’éléctron circule ( n = 1 si il est
sur la couche la
plus proche du noyau ; puis 2,3,4..)
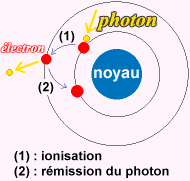
Imaginons
maintenant que l’on envoi de la lumière blanche
sur un objet rouge .Les électrons des atomes (des pigments)
de cet objet
vont absorber les
photons qui ont une longueur d’onde correspondant
à la couleur rouge en
laissant passer les autres. L’électron sera donc
excité, c'est-à-dire qu’il
aura une énergie supérieure au strict
nécessaire. Il va donc sauter de son
orbite à une orbite possédant une
énergie égale a celle qu’il vient
d’acquérir
en absorbant le photon c’est ce qu’on appelle un
«saut quantique».
Un électron dans cet état est appelé électron
excité, l’atome
n’est lui aussi plus stable il est
donc appelé atome
ionisé.
On peut alors
calculer la différence d'énergie entre les deux
niveaux grâce
a la formule :
ΔE
= Enf - Eni = B (1/ni2
- 1/nf2)
Où Enf et Eni
sont respectivement l'énergie de
l'électron à son état final et
l'énergie de l'électron à son
état initial
Une autre
équation permet de calculer la variation
d’énergie entre les deux
niveaux, c’est la formule de Planck:
ΔE
= hc/l = hn
Où h est la constante de Planck
égal à 6,626 x 10-34 J.s;
c est
la vitesse de la lumière = 3,00 ´ 108
m/s; l
est la longueur d'onde en nm du
photon émis ou absorbé;n
est la
fréquence de la lumière émise ou
absorbée en s-1 (Hz).
Finalement
l’équation donne :
ΔE
= Enf - Eni = B (1/ni2
- 1/nf2)
= hc/l = hn.
Si ΔE
>
0, l'électron a absorbé de
l'énergie. Il est passé d’un orbite de
niveau
d'énergie inférieur à un orbite de
niveau supérieur.
Si ΔE
<
0, l'électron a émis de
l'énergie. Il est passé d'un orbite de niveau
d'énergie supérieur à un orbite de
niveau inférieur
Cet état
d'excitation
n'est pas un état stable pour un électron et ne
dure pas indéfiniment :
l'électron va au bout d’un moment retourner
à
l'orbite ayant une plus petite
énergie. Il va alors rendre l'énergie qu'il avait
gagnée. Pour cela, l’électron
a plusieurs possibilités :
soit
sous forme d'un photon de même énergie de celui
qui avait percuté l'électron,
ces deux photons auront la même longueur d’onde,
donc la même couleur. (théorie d’Albert
Einstein (en 1904), qui
consiste à dire que « la
désexcitation
l'atome libérerait l'énergie
excédentaire par émission d'une particule: le
photon. » )
Le
photon peut ne pas être totalement
réémis, en passant par
la fluorescence (réémission à couleur
différente), la phosphorescence
(réémission très retardée),
la couleur (l'absorption partielle), ect. Les photons peuvent
être absorbés sous forme d'agitation
thermique (l'électron qui absorbe le photon UV se
désexcite non plus par
émission de photon , mais en faisant vibrer le
réseau d'atomes).
Chacune des
orbites, selon sa distance par rapport au noyau, est
associée à
une énergie spécifique. Selon
son orbite l’électron aura une énergie
différente, cette énergie a valeur fixe, une
valeur quantifiée. On dit donc que l'énergie
de l'électron est
quantifiée c’est
ainsi que seul les photons possédant une énergie
égale à la
différence d'énergie entre deux niveaux peuvent
être absorbés. On parle alors
de Quantum ou de Quanta qui
représente la plus
petite mesure énergétique indivisible.
Les atomes
possèdent un nombre limité de niveaux
d'énergie contenant des électrons
qui peuvent être excités. Donc pour un atome
donné, par exemple le silicium, il
n'existe que quelques valeurs de longueurs d'onde qui peuvent provoquer
l'excitation
d'un ou plusieurs électrons de niveaux d'énergie
différents.
On
voit bien sur cette animation les differentes longueurs d'ondes de
photon qui sont susceptibles d'être envoyés par
rapport au
niveau de l'éléctron d'un atome X
Or il se trouve
pour le cas du verre qu’il n’existe aucune longueur
d’onde
de la lumière visible qui puisse ioniser les atomes de
verres. Parmi tous les
photons de longueurs d’onde comprise entre 380 et 780 nm
aucun n’est absorbé.
Néanmoins la majorité des rayons UV et quelques
rayons infrarouges (longueur
d’onde comprise entre 50 et 400 nanomètres et
entre 700nm et 1 mm.) sont
absorbés. C’est pour cela qu’il est
difficile de bronzer à travers une vitre. Ainsi
si l’œil humain avait la capacité de
voir les UV par exemple alors le verre ne
serait plus transparent mais opaque.
Petite
parenthèse pour les
professeurs!
EXPERIENCE
